
根據WHO宣布 Covid-19 已終止緊急狀態。因此,各國對 Covid-19 疫苗的需求也根著趨緩,導致 BioNTech 的疫苗銷售收入下滑,逐漸常態化。為此,BioNTech 的股價也開始下滑,逐漸接近合理價位。2023 年全年營收預期為50億歐元。基於2022淨值每股82.4元加上2023第一季獲利,淨值預計將達到84.45元。據產業平均 P/B 倍數 2.39 估算,估值為202元。隨著淨值可能在年底達到90歐元,賈斯汀估值為219元。此外,BNT316 作為癌症藥物計劃今年開始進入第三期臨床實驗,若能成功獲得藥證,可能會引發股價漲勢。可以逢低分批佈局等待好消息的到來。
BioNTech 公司簡介
BioNTech 是一家生物科技公司,主要的目標是開發和生產創新的生物製劑,包括個性化癌症疫苗、基因療法、以及疫苗等產品。BioNTech 在世界范圍內都扮演著重要的角色,對世界的貢獻包括以下幾個方面:
- COVID-19 疫苗:BioNTech 與 Pfizer 合作開發了 BNT162b2 mRNA COVID-19 疫苗,這是世界上首個獲得 FDA 緊急使用授權的 COVID-19 疫苗之一,也是目前全球使用最廣泛的疫苗之一。疫苗的成功研發對於全球抗疫工作做出了巨大貢獻。
- 癌症治療:BioNTech 開發的客製化癌症疫苗是一種新興的治療方法,可以根據患者的基因變異情況設計出個性化的疫苗,以刺激患者的免疫系統攻擊腫瘤細胞。這種治療方法對於提高癌症患者的存活率和生存期有著重要的貢獻。
- 傳染病疫苗:BioNTech 也在研發多種傳染病疫苗,包括結核病、帶狀疱疹等疫苗,這些疫苗的研發和生產能夠有效地預防和控制這些傳染病的流行。
BioNTech 在醫學和生物科技領域的研究和發展為全球健康和生命做出了極其重要的貢獻。他們的創新研究和產品能夠幫助減輕人類疾病的負擔,改善人類的生活質量,為人類的健康和福祉帶來積極的影響。
2023 Q1 財報
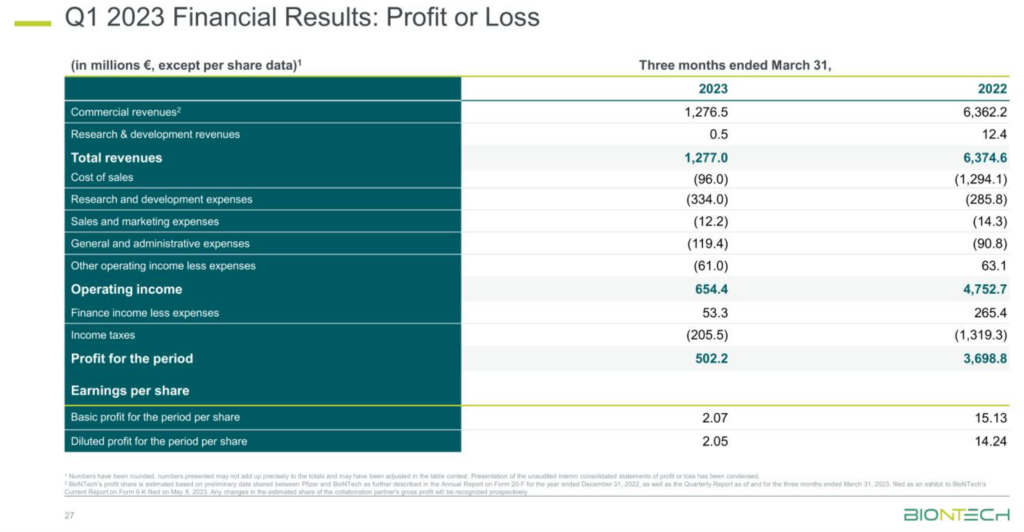
Financial Review for the First Quarter 2023
| in millions €, except per share data | First Quarter 2023 | First Quarter 2022 | ||||||
| Total Revenues2 | 1,277.0 | 6,374.6 | ||||||
| Net Profit | 502.2 | 3,698.8 | ||||||
| Diluted Earnings per Share | 2.05 | 14.24 |
| 種類 | 定義 | 案例 |
|---|---|---|
| 商業收入 | 來自直接銷售產品和合作夥伴區域內 COVID-19 疫苗銷售的收入 | BioNTech 2023 年度 COVID-19 疫苗收入約為 € 50 億,其中包括來自 COVID-19 疫苗銷售的直接收入和來自與 Pfizer 等合作夥伴的分紅收入 |
| 研究開發收入 | 從政府、非政府組織或私人機構獲得的資金,用於支持研究和開發活動 | BioNTech 從歐盟委員會獲得了 1.20 億歐元的撥款,用於加速 COVID-19 疫苗和其他治療方法的研發和生產,這些款項被歸類為研究開發收入 |
以下是 BioNTech 的商業收入和研究開發收入說明:
商業收入是來自公司商品或服務的銷售所產生的收入,而研究開發收入則是來自政府、非政府組織或私人機構為支持公司研究和開發活動提供的資金。BioNTech 的商業收入主要來自 COVID-19 疫苗的銷售,而研究開發收入則主要來自政府和非政府組織的撥款。
2023年展望
公司首席財務官Jens Holstein表示:“在2023年第一季度,我們的財務表現完全符合我們的預期,並按照我們的資本配置優先事項進行了增長和推進我們的臨床階段管線,宣布了多個重大業務發展交易,並繼續推進我們的股票回購計劃。”“在2023年的其餘時間裡,我們將繼續專注於實現我們的目標,並繼續為我們的患者和股東提供價值。”

BioNTech COVID-19 疫苗在2023財年的收益: 預估BioNTech COVID-19疫苗在2023財年全年的收益為 ~ 50億歐元
此收益估算反映預期的收益,包括BioNTech在合作夥伴領土內COVID-19疫苗銷售毛利的份額、在BioNTech領土內直接COVID-19疫苗銷售的收益以及BioNTech生產並銷售給合作夥伴的產品預期產生的收益,這些收益可能會受到成本(例如物料化後與合作夥伴Pfizer分享的存貨報廢)的影響。
收益指引基於多種假設,包括但不限於在某些地區預期從先進採購協議環境轉向商業市場訂單,以及預期有規制機構建議對COVID-19疫苗進行調整以應對新流行的SARS-CoV-2變異株或亞型。預估的BioNTech COVID-19疫苗收益反映現有或已承諾的供應合約下預期的交付和通過傳統商業訂單預期的銷售。與歐洲委員會的現有供應合同正在進行重新協商,可能會重新分配在多年中交付劑量和/或減少劑量。盡管預期疫苗調整會增加需求,但預期一次性接種疫苗的人數會減少,並預期全民增強程度會降低。假設季節性需求,預期收益產生主要集中在2023年下半年。
腫瘤學新產品線
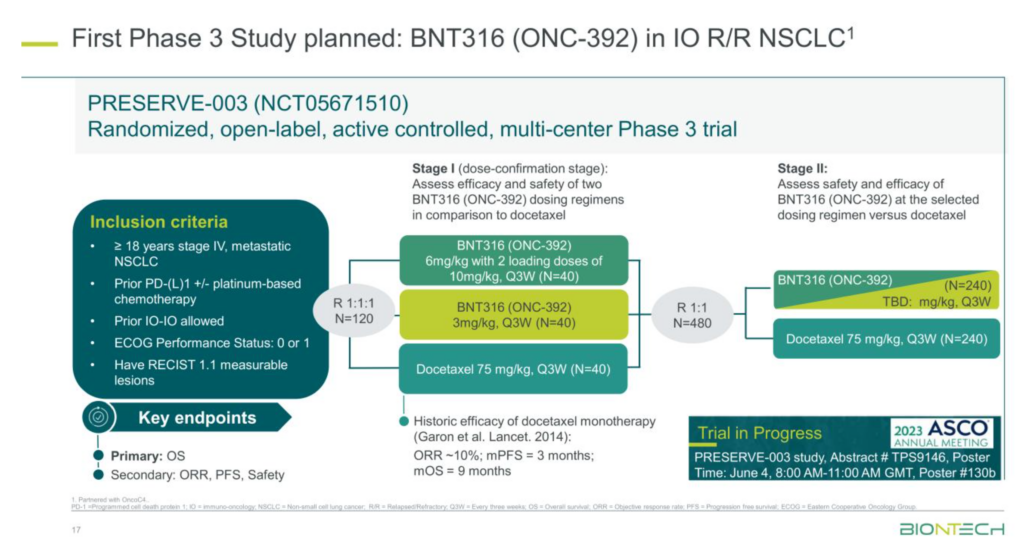
BNT316(ONC-392)
BNT316(ONC-392)是一種與OncoC4合作開發的抗CTLA-4單克隆抗體候選藥物。 BNT316(ONC-392)提供了一種可能不同於其他療法安全性配置的方案,可允許以更高的劑量和更長的治療期作為單獨治療和與其他治療方法結合使用。 •BioNTech和OncoC4計劃在2023年開始一項III期臨床試驗,評估BNT316(ONC-392)作為單獨治療非小細胞肺癌(NSCLC)患者,這些患者在抗PD-1 / PD-L1抗體療法失敗後。 •BioNTech和OncoC4計劃在2023年美國芝加哥舉行的美國臨床腫瘤學會(ASCO)年度會議上,作為進行中的I / II期臨床試驗的一部分,發表評估BNT316(ONC-392)作為單獨治療NSCLC患者的擴展群體數據。
BNT323(DB-1303)
BNT323(DB-1303)是一種針對HER2的抗體藥物聯合物(ADC)候選藥物,與DualityBio合作開發。 •BNT323(DB-1303)目前正在進行I / II期臨床試驗,用於治療晚期/無法切除,復發或轉移的HER2表達實體瘤患者。 BioNTech和DualityBio期望在2023年ASCO年度會議上從進行中的試驗中獲得數據更新。 •在1月,BNT323(DB-1303)獲得美國食品藥品監督管理局的快速通道指定,用於治療進展了標準系統治療的HER2過度表現的晚期,復發或轉移的子宮內膜癌患者。
Autogene cevumeran (BNT122)
Autogene cevumeran (BNT122)是一種基於個體化新抗原特異性免疫治療 (iNeST) 方法的mRNA癌症疫苗候選者,該方法是與羅氏集團成員基因泰克公司合作開發的。 •2023年計劃開展BNT122在胰腺管癌 (PDAC) 前瞻性治療的2期臨床試驗。
BNT211是一種自體同源的CLDN6靶向嵌合抗原受體 (CAR) T細胞療法,正在單獨和與編碼CLDN6的CAR-T細胞增強RNA疫苗,或稱CARVac,進行測試。 •BioNTech預計在2023年ASCO年會上公佈一項正在進行的1/2劑量逐步升級和擴展的臨床試驗,以評估CLDN6陽性復發或難治性晚期實體瘤患者的數據更新。
傳染病領域研發新產品線
下一代COVID-19疫苗項目BNT162b2 + BNT162b4
•BioNTech於4月份報告了有關BNT162b4的預臨床數據,該疫苗成分編碼來自非突變spike抗原的T細胞表位,單獨使用或與編碼完整spike蛋白的BNT162b2結合使用,候選疫苗可以保護免受嚴重COVID-19疾病的影響並增強病毒清除能力。研究結果已在同行評審期刊Cell上發表(Arieta C. et al. The T-cell-directed vaccine BNT162b4 encoding conserved non-spike antigens protects animals from severe SARS-CoV-2 infection, Cell (2023), doi: https://doi.org/10.1016/j.cell.2023.04.007.)。 •正在進行一項1期臨床試驗,評估BNT162b4與BNT162b2組合使用的安全性、耐受性和免疫原性。
結核疫苗計畫 – BNT164
•BioNTech於四月份與比爾及梅琳達·蓋茨基金會合作啟動了一個隨機、對照、劑量探索的BNT164第一期臨床試驗。該臨床試驗將評估mRNA疫苗候選對結核病的安全性、反應原性和免疫原性。
帶狀疱疹疫苗計畫 – BNT167
•BioNTech和輝瑞公司於二月份啟動了一個多中心、隨機、對照、劑量選擇的BNT167第一/二期臨床試驗,該公司的mRNA疫苗候選對帶狀疱疹(也稱為帶狀疱疹病毒)進行預防。該臨床試驗將評估mRNA疫苗候選對帶狀疱疹的安全性、耐受性和免疫原性。
資料來源:BioNTech
https://investors.biontech.de/node/15021/html
註1:
醫藥人體試驗一般分為四個階段,通常稱為 Phase 1 至 Phase 4。
Phase 1 為首次在人體進行測試,主要是評估藥物的安全性,以及確定適當的劑量範圍。通常,這個階段的試驗是在小規模的受試者中進行,例如 20 至 100 人。
Phase 2 主要是為了進一步評估藥物的安全性和療效。在這個階段,通常涉及到更多的受試者,並且通常會將受試者分成治療組和對照組進行比較。
Phase 3 是進一步確定藥物的療效和安全性,這個階段需要涉及大量的受試者,通常是數千人。在這個階段,通常會將受試者分成不同的群體進行比較,例如不同的年齡、性別和種族等。
Phase 4 為藥物上市後的後續試驗,也稱為後市場監測。這個階段的試驗主要是為了繼續監測藥物的安全性和療效,以及擴大藥物的使用範圍。
註2:
非小細胞肺癌(Non-Small Cell Lung Cancer,NSCLC)是一種惡性肺腫瘤,佔所有肺癌病例的80%至85%。相較於小細胞肺癌(SCLC),NSCLC的生長速度較慢,較不易擴散到其他部位,也較不會對化療反應良好。常見的NSCLC亞型包括肺腺癌(adenocarcinoma)、鱗狀細胞癌(squamous cell carcinoma)和大細胞癌(large cell carcinoma)。




One thought on “BioNTech:疫苗需求趨緩,BNT316癌症新藥帶來新機會”